in caricamento ...
Investitori concentrati alla scoperta del titolo biotech del 2014! Oggi vi presentiamo BioLineRX (BLRX).
A volte alcune aziende biotech sembrano dimenticate dai grossi analisti, da coloro che scrivono sui siti specializzati del settore, insomma dagli investitori in generale e dagli speculatori. Devo dire che questo è uno dei fattori che mi ha sempre attirato quando valuto le aziende biotech.
E’ forse facile salire in corsa su aziende con solidità economica e con una forte pipeline, ma risulta spesso noioso.
Noi piccoli investitori siamo sempre alla ricerca del colpo a sorpresa, ad effetto, questo è forse quello che personalmente ed economicamente mi da più soddisfazione.
Negli ultimi due anni sono diversi gli esempi che possiamo fare di aziende che quotavano una miseria e che nel giro di poco sono esplose, due di queste le abbiamo viste da vicino di recente ovvero Celldex Therapeutics, Inc. (CLDX) ed IntelliPharmaCeutics International Inc. (IPCI) ma quale sarà la prossima?.
Tra le aziende che sto monitorando da un po’ un azienda Istraeliana, ovvero BioLineRx (BLRX) ha raccolto la mia attenzione per una serie di motivi. Il primo che balza all’occhio e che l’azienda ha una pipeline teoricamente esplosiva con tantissimi candidati e molti di questi blockbuster.
Investire su un’azienda Istraeliana potrebbe far storcere il naso, vista la situazione geopolitica sempre appesa a un filo, e inoltre gli investitori americani tendono spesso a ignorare tutto ciò che non è a stelle e striscie.
A volte quando un’azienda ha una pipeline così estesa c’e’ il rischio che si possano disperdere soldi ed energie in tanti insuccessi, ma se teniamo conto della capitalizzazione così bassa anche solo con uno o due candidati farmaci con risultati positivi questa è destinata anche in modo veloce ad aumentare e non di poco.
Come sempre dobbiamo ricordarci che puntare su un’azienda che ha entrate basate sulle vendite pari a zero e che ha canditati promettenti ma indietro nello sviluppo, è sempre un grosso rischio.
La domanda che dobbiamo farci è sempre la stessa: Dove si trovano i soldi per mandare avanti l’azienda ? Con partner, finanziamenti governativi ed emissioni azioni. Questo BLRX lo sta facendo.
Prima accennavo ad alcuni aspetti che mi avevano incuriosito. Il primo di questi è che l’azienda è stata fondata da alcuni protagonisti della ricerca medica Istraeliana, tra cui TEVA.
La missione dell’azienda è quello di selezionare tecnologie e farmaci nei primissimi stadi di sviluppo acquistandoli direttamente dalle piccole aziende e collaborando con ricercatori, ospedali e università cercando di portarli avanti nello sviluppo.
PIPELINE PRE-CLINICA
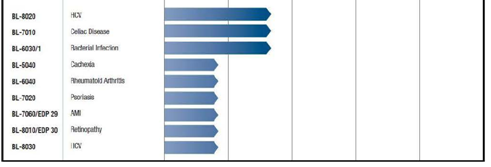
Un altro punto che ha attirato la mia curiosità è sicuramente la pipeline. Tuttavia, guardando la vastità dei candidati in sviluppo pre-clinico, il mio occhio è caduto su due candidati che, ovviamente, non possono lasciarci indifferenti. In realtà troviamo di tutto e diversi potenziali blockbuster (vedi RA e Psoriasi, solo per citarne due). Potremmo riempire pagine sulla pipeline pre-clinica ma è più semplice dare un’occhiata alla tabella seguente:
L’occhio mi è caduto su BL-8020 e BL-8030…….perchè queste due molecole hanno un’ indicazione nell’epatite C.
Il BL-8020 è un inibitore dell’autofagia HCV mentre il BL-8030 è un inibitore della proteasi NS3/4A.
Il BL-8020 è entrato in fase 1 da poco, quindi ne parleremo dopo quando descriveremo la pipeline, ma sarà interessante capire e seguire il BL-8030 quando entrerà in uno studio clinico.
Quando parliamo di epatite C ci viene subito in mente ciò che abbiamo visto negli ultimi anni, ovvero le acquisizioni di Inhibitex da parte di Bristol Myers Squibb per 2,6 miliardi di $, l’accordo tra Vertex e Alios Biopharma che potrebbe portare introiti fino a 700M di $ e per concludere l’acquisto da parte di Gilead di Pharmasset per svariati milioni di dollari.
Mentre BL-8020 potrebbe essere un add-on ai regimi di trattamento esistenti, BL-8030 invece si propone come protagonista nella terapia contro Il virus dell’epatite C (HCV) e anche in combo.
Cosa ha attirato la mia attenzione?. Questo è stato pagato 500 mila dollari cifra di tutto rispetto da non sottovalutare. Il fatto che sia ancora in fase preclinica però non ha compromesso di siglare un accordo che a Giugno è già stato siglato ovvero…
“BioLineRx (NASDAQ: BLRX; TASE: BLRX), a biopharmaceutical development company, announced today that it has signed an out-licensing agreement with Jiangsu Chia-tai Tianqing Pharmaceutical Co., Ltd. (CTTQ), the leading Chinese pharmaceutical company in the liver disease therapeutic area, for the development and commercialization of BL-8030, an orally available treatment for the Hepatitis C virus (HCV).
Under the terms of the agreement, BioLineRx will grant CTTQ exclusive rights to develop, manufacture and commercialize BL-8030 in China and Hong Kong. CTTQ will pay BioLineRx an upfront license fee, plus future development, regulatory and commercialization milestones, for a total potential deal value of approximately $30 million. In addition, BioLineRx has the right to receive high single-digit royalties on future sales of the drug. BioLineRx will retain the right to develop and commercialize BL-8030 in other parts of the world. CTTQ will adhere to FDA and EMA guidelines in pre-clinical development and manufacturing of BL-8030. BioLineRx will have access to all development and regulatory data generated by CTTQ, as well as the right to use this data for commercialization and regulatory purposes in all areas of the world outside of China and Hong Kong.”
Quindi accordo per la commercializzazione in Cina e Hong Kong con $30M di potenziali pagamenti e royalties nell’ordine del 6-9%.
Tutto ciò potrebbe far sorridere ma se teniamo conto che BMY ha acquisito Inhibitex quando era in fase I capirete che in questo settore le tappe vengono bruciate in poco tempo.
Perché questa molecola è così interessante da strappare un partner già a Giugno 2013? Oltre al profilo di sicurezza e a qualche dato preclinico che sicuramente fa ben sperare, è stata scoperta dal Prof. Philippe Halfon e dal suo team in collaborazione con RFS Pharma azienda fondata dal prof Raymond Schinazi.
Schinazi per chi non lo sapesse è uno dei principali fondatori di Pharmasset e di Idenix, altra azienda con accordo miliardario con GlaxoSmithKline. Questo magari non vuol dire niente ma è un interessante biglietto da visita e sicuramente non passerà inosservato. La cifra pagata dall’azienda ovvero 500 mila $ è un cifra piuttosto alta, ma se teniamo conto del potenziale mercato futuro, tra qualche anno, potrebbe essere uno dei migliori investimenti mai realizzati dall’azienda.
Questa mia premessa va però a scontrarsi con il fatto che il mercato ormai è saturo di questo genere di farmaci ed essendo questo candidato indietro con lo sviluppo anche dovesse entrare nel mercato c’e’ il grosso rischio che sia obsoleto. Resta comunque intrigante capire che ambizioni avrà l’azienda su BL-8030 alla luce degli investimenti fatti e che farà in futuro.
Per chiudere la parte della pipeline pre-clinica è da poco arrivata la notizia di un altro accordo commerciale e di sviluppo, sempre nel mercato asiatico, del BL-9020 che è un altro potenziale blockbuster con indicazione nel Diabete di tipo 1.
“Taiwan, Jan. 8, 2014 BioLineRx (BLRX), a clinical-stage biopharmaceutical company dedicated to identifying, in-licensing and developing promising therapeutic candidates, and JHL Biotech, a biopharmaceutical company that develops, manufactures, and commercializes biologic medicines, announced today that they have entered into an agreement to collaborate in the development and commercialization of BL-9020, a novel monoclonal antibody for the treatment of Type 1 diabetes.
Pursuant to the collaboration agreement, JHL Biotech will be responsible for all process development and manufacturing of BL-9020 during its pre-clinical and clinical development stages, and BioLineRx will be responsible for all pre-clinical development of BL-9020. Responsibility for clinical development of BL-9020 will be shared by the parties on a regional basis.”
Sarà per l’ubicazione a metà strada tra Europa e Asia ma di recente sembra che l’azienda stia preparando la strada più verso l’asia, mercato devastante come numero di potenziali malati ovviamente, mentre in Europa e Usa secondo me, dati clinici più consistenti potrebbero anche far arrivare partner di peso per l’azienda. Ovviamente mi riferisco soprattutto a TEVA che sarà sicuramente in pole e starà osservando il tutto dal di fuori.
Se avevamo descritto la parte pre-clinica come vasta, non sono da meno gli studi clinici già partiti della pipeline. Eccoli:
TRIAL CLINICI:
La pipeline di Bioline (BLRX) è ricca e variegata e include candidati farmaci per diverse patologie tra cui quelle di maggiore importanza sono: leucemia mieloide acuta e mobilizzazione cellulare, celiachia, epatite C, lesioni cutanee e rimodellamento ventricolare in seguito ad infarto miocardico acuto.
L’immagine sottostante illustra la pipeline completa di Bioline a Febbraio 2014:
Per ogni potenziale farmaco andiamo quindi brevemente a vedere i trial clinici in corso ed eventualmente quelli già conclusi:
1) BL-1040 Rimodellamento ventricolare in seguito ad infarto miocardico acuto.
Trial clinico NCT01226563 (PRESERVATION 1), che testa l’efficacia e la sicurezza di BL-1040, (considerato dalle autorità regolatorie non come farmaco, ma come dispositivo medico) in pazienti che hanno avuto un infarto miocardico al fine di supportare la guarigione del tessuto cardiaco e prevenite il rimodellamento ventricolare.
E’ uno studio chiave registrativo, che in caso di esito positivo permetterà all’azienda di ottenere il marchio CE e conseguentemente di commercializzare il dispositivo in Europa. Bl-1040 non è altro che un polimero liquido (viene considerato comunque come un impianto a livello del miocardio) che in seguito ad infarto viene iniettato direttamente nelle arterie coronariche della zona interessata e che, una volta dentro, va a depositarsi nel tessuto infartuato trasformandosi da liquido a gel e quindi funzionando da “scaffold” e fornendo supporto meccanico al tessuto cardiaco. Rimane come gel per circa 6 settimane e alla fine del trattamento si ritrasforma nuovamente in forma liquida e viene espulso dal corpo.
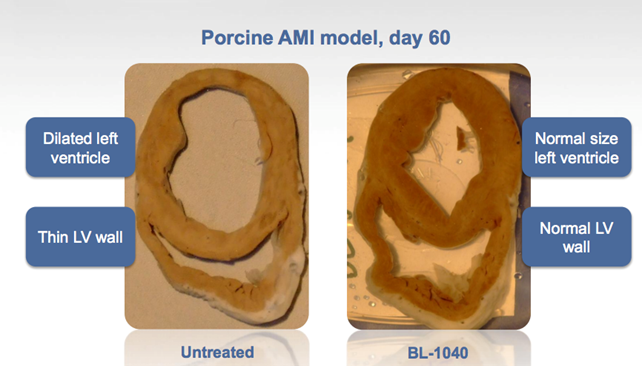
Bl-1040 previene quindi i cambiamenti di struttura del tessuto infartuato durante la sua guarigione ed ha ottenuto ottimi risultati negli studi pre-clinici su modelli animali, come si può osservare nell’immagine sottostante nel modello suino. Per questo candidato farmaco si è utilizzato il modello suino perché il maiale è l’animale con il cuore più simile al nostro come forma e dimensioni, tanto che in tempi passati se ne studiavano le caratteristiche per capire come poterlo utilizzare negli xenotrapianti.
I risultati sono stati incoraggianti sia dal punto di vista della sicurezza che dell’efficacia: non si sono verificati effetti collaterali collegati al trattamento (aritmie, innalzamento di valori enzimatici o occlusioni) e i dati preliminari suggeriscono una buona efficacia.
Il trial registrativo, come abbiamo detto, è attualmente in corso. E’ uno studio di fase II/III che arruola 306 pazienti in 75 centri distribuiti in 9 paesi (tra cui 15 centri negli USA). E’ in doppio cieco, con placebo, 6 mesi di follow-up e gli endpoint sono: misura del volume diastolico ventricolare alla fine del trattamento, test di camminata di 6 minuti (6MWT) e vari questionari compilati sia dai pazienti che dai medici.
I risultati del trial sono previsti nel 2H14, mentre l’azienda sta pianificando con l’FDA un altro trial chiave (necessario per l’approvazione del dispositivo negli USA) che dovrebbe arruolare più di 1000 pazienti e avere un follow-up di 12 mesi.
Lo sviluppo del farmaco avviene in collaborazione con il partner Ikaria che si fa carico di tutti i costi. La struttura dell’accordo tra le due società prevede che Bioline riceva $282,5M in diversi step al raggiungimento di determinati obiettivi regolatori e commerciali (attualmente Bioline ha già ricevuto da Ikaria pagamenti per $17M).
Visto i buoni risultati ottenuti nello studio pilota (nonostante il basso numero di pazienti arruolati) e visto il meccanismo di azione del farmaco prevedo una buona possibilità (70%) che lo studia possa centrare gli endpoint primari ed una probabilità del 50% che possa centrare anche i secondari.
2) BL-8040 – Agonista inverso del recettore CXCR4 – Leucemia Mieloide Acuta
Prima di parlare del trial clinico, soffermiamoci un attimo sul recettore per capire il ruolo che ha nel nostro organismo e i motivi per cui è così interessante il BL-8040 come suo antagonista.
In un corpo perfettamente funzionante CXCR4 è espresso dalle cellule del sistema nervoso e del sistema immunitario, tale recettore si lega con il fattore di sviluppo CXCL12.
Questa interazione è fondamentale durante il primo sviluppo embrionale ed è necessaria per la corretta formazione del sistema sanguigno, nervoso e cardiaco. Tale interazione rimane vitale nel corpo adulto perché da la direzione alle cellule staminali ematopoietiche nel midollo osseo.
In sintesi parliamo dei meccanismi base per la creazione stessa delle cellule che poi andranno a formare il nostro corpo, da qui è facile capire che quando una cellula cancerosa inizia ad overesprimere il recettore CXCR4 si attiva un pathway molecolare che può influenzare la biologia del tumore e giocare un ruolo chiave direzionando le metastasi in organi che esprimono il fattore CXCL12.
Recenti studi hanno dimostrato che CXCR4 è iper-espresso nelle cellule dei seguenti tumori: polmone; seno; ovarie; prostata; colon e vescica. Direi che quindi la situazione merita la nostra attenzione e di conseguenza possiamo tornare a parlare del trial clinco.
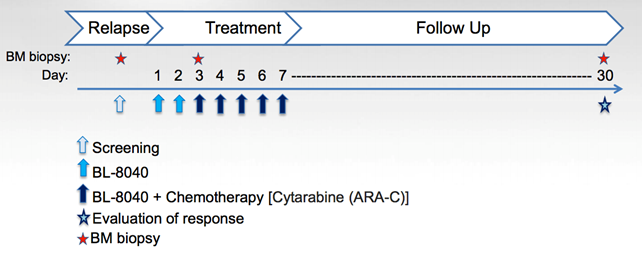
Trial clinico di fase IIa (multi-centro e open-label), NCT01838395 (massimo 50 pazienti) per valutare la sicurezza e l’efficacia di dosi crescenti del farmaco in combinazione con la citarabina nel trattamento della leucemia mieloide acuta, refrattaria o recidiva, in pazienti adulti.
L’endpoint primario dello studio è la sicurezza e la tollerabilità, mentre gli endpoint secondari includono l’efficacia clinica, l’effetto apoptotico sulle cellule leucemiche nel sangue periferico e nel midollo osseo, la mobilizzazione dei blasti dal midollo al sangue periferico e il profilo farmacocinetico.
Lo studio attuale è stato disegnato sulla base dei risultati di un precedente studio di fase I/II condotto su 18 pazienti con mieloma multiplo per dimostrare sia il grado di sicurezza del farmaco che la sua capacità di mobilizzare cellule staminali ematopoietiche (CD34+) dal midollo osseo al sanfue periferico.
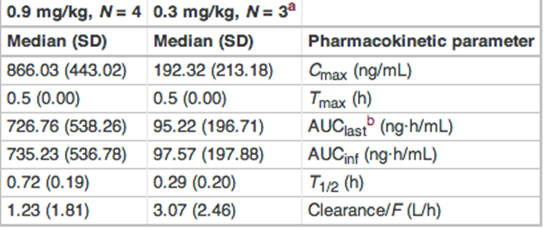
I pazienti oggetto dello studio hanno ricevuto un’iniziezione singola sottocutanea di BKT140 in 5 diverse dosi: 0.006, 0.03, 0.1, 0.3, e 0.9 mg/kg. Quello che ci interessa conoscere del precedente studio sono il profilo farmacocinetico del farmaco e la sua sicurezza, che sono anche gli endpoint dello studio attualmente in corso:
Profilo farmacocinetico di BL-8040:
Come si evince dalla tabella sopra, il profilo farmacocinetico ci dice che il farmaco ha una buona clearance (la concentrazione plasmatica anche alla massima dose testata raggiunge il picco a 30 minuti e poi declina rapidamente) e che l’efficacia potrebbe essere correlata con la dose di farmaco.
Sicurezza:
Lo studio clinico ha dimostrato una buona sicurezza e non si sono registrati effetti collaterali di grado 3 e 4 correlati al farmaco. Tuttavia, poiché il farmaco non è stato somministrato da solo, ma in combinazione con il G-CSF, molti effetti collaterali non sono stati direttamente imputabili al farmaco stesso e quindi non considerati nel computo generale. Riporto direttamente dal paper:
“About 40% of treatment emergent adverse events (TEAEs) (13/33 reported in 5 subjects) were considered definitely, possibly, or probably drug related. All related TEAEs (13/13) were in the higher dose groups (0.3 and 0.9 mg/kg), 61.5% (8/13) were under MedDRA system class “General Disorder and Administration Site Condition.” More than three quarters of the related TEAEs were considered “mild” in intensity (10/13) 23.1% “moderate” (3/13). The investigator did not consider any of the “severe” events as related to the study drug, whereas the sponsor’s Medical Safety Officer considered one “severe” AE (1/12; 8.3%) as related to the study drug. The median duration of AEs throughout this study was 3 days (range 1–31 days).
There were a total of 6 serious adverse events (SAEs) reported throughout the study, affecting 4 of 18 subjects (22.2%), 1 subject in the 0.006 mg/kg dose group, 2 subjects in the 0.1 mg/kg dose group, and 1 subject in the 0.3 mg/kg group.
Two concurrent SAEs in a 0.3 mg/kg subject (chest pain and dyspnea) were considered by the investigator to be related to investigational study treatment because of proximity of timing to drug administration; however, the sponsor’s Medical Safety Officer acknowledged that the events were similar to those anticipated with administration of G-CSF, and therefore these SAEs were considered “unrelated” to study drug. Another SAE, hypokalemia in subject no. 008 (0.1 mg/kg group) was determined to be unrelated by the investigator and as possibly related to the study product by the sponsor’s Medical Safety Officer (based on review of the CRF and laboratory data).
The majority of laboratory abnormalities were noted at screening and 24 hours postdosing, improving, or resolving by day 7 postdosing. Notable exceptions in hematology were neutrophil and lymphocyte %WBC values, particularly progressive increases in neutrophils postadministration of study drug, a function of the intended application of the drug. Exceptions in blood chemistry included potassium, where there was a noticeable decrease postadministration of the study treatment and glucose and LDH, for which there were notable elevations postadministration of study treatment in subjects, none associated with sequelae; other clinically significant chemistry parameters considered AEs were determined to not have been related to study treatment, with values returning to normal by study end. There were no notable differences between study dose groups.”
Quello che ci lascia perplessi è, insomma, il fatto che tutti gli effetti collaterali relativi al trattamento si siano verificati nel gruppo di pazienti che hanno ricevuto le dosi più alte di farmaco e la discrepanza tra le idee del ricercatore e il comitato di sicurezza dello studio nell’attribuire alcuni effetti collaterali come relativi al trattamento o meno lasciano un po’ perplessi sull’analisi dei dati.
Ad ogni modo gli effetti collaterali evidenziati non sono di grado severo (tranne 1) e i risultati ad interim dello studio di fase 2a attualmente in corso, come riportato dall’azienda, hanno mostrato un buon profilo di sicurezza del farmaco fino alla concentrazione di 1mg/kg (la massima che verrà testata nello studio sulla AML è di 1,5 mg/kg).
Insomma, in attesa dei dati completi dello studio di fase 2a, previsti nel 4Q14, basandoci su quanto visto nei precedenti studi e sui risultati ad interim rilasciati a Dicembre, possiamo affermare che la sicurezza non dovrebbe essere un problema in questo trial e quindi stimiamo una buona possibilità (>70%) che lo studio possa centrare gli endpoint primari.
Ricordando come è disegnato lo studio di fase 2a (screening, 3 giorni di trattamento con BL-8040 e successivamente BL-8040 più citarabina):
Per quanto riguarda l’efficacia, sempre dai dati ad interim rilasciati dall’azienda, riportiamo direttamente le parole del CEO:
“Anche se lo studio è in una fase iniziale e non abbiamo ancora valutato tutte le dosi del farmaco (sono arrivati alla 1mg/kg ndr), abbiamo già intravisto una impressionante mobilizzazione delle cellule tumorali dal midollo osseo al sangue ad un tasso che è nettamente superiore a quello osservato per gli altri farmaci nella stessa indicazione. In aggiunta, intravediamo già i primi segnali di una robusta apoptosi delle cellule tumorali, analogalmente a quanto già visto negli studi pre-clinici”.
Questo invece quanto afferma il Dr. Gautam Borthakur dell’Anderson Cancer Institute di Houston, principale ricercatore dello studio:
“I primi risultati del trial di fase 2 per BL-8040 mostrano un notevole effetto apoptotico del farmaco sulle cellule AML e questo è eccezionale nella sua abilità di indurre sia la mobilizzazione delle cellule tumorali dal midollo osseo sia la concomitante morte cellulare. Ho quindi grandi speranze che questo farmaco possa aggiungersi al limitato arsenale di farmaci utilizzabili per combattere l’AML”.
Sempre l’azienda, tramite la sua presentazione di Febbraio alla conferenza BIOCEO14, ci fornisce alcuni grafici che mostrano gli effetti del farmaco sulla mobilizzazione cellulare e l’apoptosi delle cellule tumorali leucemiche.
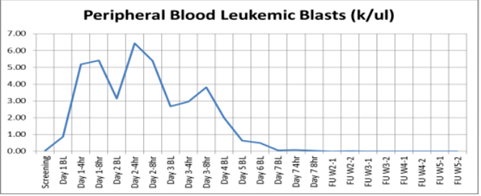
Mobilizzazione blasti:
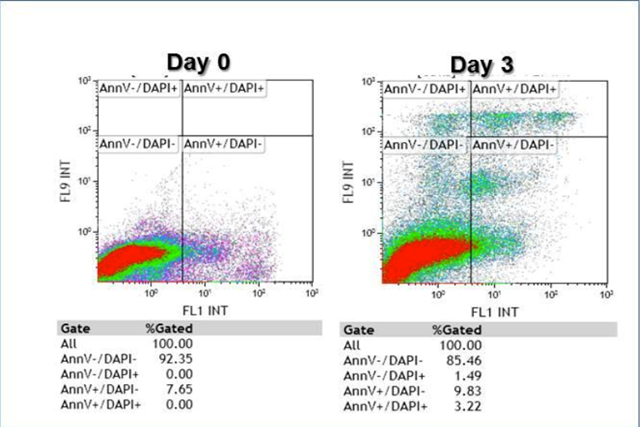
Apoptosi:
Come si evince dai grafici, si nota una impressionante mobilizzazione cellulare dei blasti leucemici e una buona percentuale di apoptosi (quadrante in basso a destra cellule in fase iniziale di apoptosi e in alto a destra in fase tardiva di apoptosi).
Insomma, i primi dati relativamente all’efficacia del trattamento sono ottimi e il farmaco è molto promettente. Sicuramente sarà interessante valutare (anche in vista di un possibile trial di fase 3) l’effetto combinato del trattamento BL-8040/Citarabina, in quanto, visti gli effetti sulla mobilizzazione, il trattamento con il chemioterapico potrebbe giovarne in larga misura.
Per concludere, a parte possibili sorprese derivanti dal profilo di sicurezza del farmaco, per questo trial mi aspetto un possibilità di centrare gli endpoint dell’80%. Sarà interessante valutare poi tutti gli effetti del trattamento, in quanto dei risultati clamorosi in termini di efficacia potrebbero aprire facilmente la strada ad altre indicazioni e destinare il farmaco allo status di blockbuster.
Ricordo infine che BL-8040 ha ottenuto lo status di farmaco orfano per entrambe le indicazioni (mobilizzazione cellulare e AML) e che attualmente l’azienda sta testando il farmaco in diversi studi pre-clinici con ottimi risultati anche nel trattamento del Linfoma non Hodgkin in combinazione con Rituximab e nella leucemia mieloide cronica in combinazione con Imatinib.
Per completezza riporto dal paper sul linfoma non Hodgking:
“B-cell non-Hodgkin’s lymphoma (NHL) represents the most common malignant lymphoid neoplasm. Although anti-CD20 antibody rituximab significantly improved the outcome of patients with NHL, the relapsed/refractory rates are still high. Chemokine receptor CXCR4 and its ligand CXCL12 are critically involved in the survival and trafficking of normal and malignant B lymphocytes. The interaction of malignant B cells with stromal cells via CXCR4/CXCL12 signaling may provide chemoresistance. Therefore, blockade of CXCR4 may antagonize the survival and spreading of lymphoma cells and restore their chemosensitivity.
Our results show potent antilymphoma effect of CXCR4-specific high-affinity antagonist BKT140 in vitro and in vivo. The BKT140-mediated antilymphoma effect synergizes with that of rituximab. Moreover, BKT140 effectively targets lymphoma cells in the bone marrow microenvironment, overcoming the stroma-induced resistance to rituximab.”
Considerando che il recettore CXCR4 e il pathway CXCR4/CXCL12 giocano un ruolo fondamentale in molti tipi di tumore potete ben capire l’importanza di questo inibitore. Sono convinto che se lo studio sulla AML dovesse dare risultati sorprendenti l’azienda potrebbe decidere di partire con trial clinici anche nelle altre indicazioni.
Chi fosse interessato ad approfondire i risultati degli studi preclinici nelle altre indicazioni può leggere i seguenti papers:
http://mct.aacrjournals.org/content/early/2014/02/06/1535-7163.MCT-13-0410.long (6 Febbraio 2014)
http://clincancerres.aacrjournals.org/content/19/13/3495.long (1 Maggio 2013)
3) BL-8040 – Mobilizzazione cellulare
Premessa:
La chemioterapia ad alte dosi in combinazione con il trapianto di cellule staminali autologhe (ACST) è il trattamento di prima linea in una varietà di malattie ematologiche, tra cui il mieloma multiplo, il linfoma non Hodgkin e quello di Hodgkin.
Sebbene 2×106 cellule/kg sia considerata come la dose minima necessaria per l’attecchimento delle cellule staminali ematopoietiche, una dose maggiore di cellule ( Il fattore di crescita G-CSF, che stimola la differenziazione, la sopravivenza e la migrazione dei granulociti, somministrato con la chemioterapia è comunemente usato per la mobilizzazione delle cellule staminali. Tuttavia, questo tipo di mobilitazione, non riesce a fornire un numero sufficiente di cellule staminali CD34+ in circa il 10-20% dei pazienti affetti da mieloma e nell’11-55% dei pazienti affetti da NHL.
L’utilizzo di Mobozil (AMD3100 Genzyme, plerixafor), una “small molecule” che inibisce reversibilmente il legame tra il recettore CXCR4 e il CXCL12, sembra migliorare i tassi di mobilizzazione cellulare in quei soggetti difficili da trattare. Tuttavia, anche con l’uso di Mobozil, la mobilitazione di un numero sufficiente di cellule staminali resta un obiettivo difficile in una percentuale significativa di pazienti (41% dei pazienti con NHL e 13% con mieloma multiplo), in particolare quelli trattati con lenalidomide o fludarabine come terapia di induzione.
E’ qui che entra in gioco BL-8040. Questo è un nuovo, potente inibitore del recettore CXCR4 (è un peptide sintetico di 14 aa) che si lega ad esso ad alta affinità e con un tempo di dissociazione molto più elevato (sono necessarie più di 24 ore perché BTK140 si dissoci completamente dal suo recettore). Al contrario, Mobozil si lega al CXCR4 in maniera molto più reversibile (il tempo di dissociazione è di circa 2 ore). BL-8040 ha quindi la capacità unica, se confrontato con tutti gli altri inibitori CXCR4, di spegnere completamente il pathway che regola il traffico cellulare nel midollo osseo. Questo porta ad un forte effetto sinergico quando il BTK140 è usato in combinazione con il G-CSF, risultante in una forte e robusta mobilizzazione di cellule staminali ematopoietiche e quindi in una terapia superiore all’attuale standard of care.
Uno studio pilota di fase 1, non randomizzato, open-label, che ha testato concentrazioni crescenti del farmaco su 18 pazienti (al loro primo trapianto autologo) con mieloma multiplo, è stato portato avanti lo scorso anno in 2 diversi centri in Israele e i risultati pubblicati nel mese di Gennaio 2014 su Clinical Cancer Research.
Sulla base dei risultati di questo studio, ora l’azienda punta ad iniziare un altro studio di fase 1 durante il 1H14 (probabilmente randomizzato e con l’obiettivo di comparare la terapia con BL-8040 direttamente contro Mobozil).
Abbiamo già parlato dei parametri di farmacocinetica e della sicurezza di questo studio precedentemente, vediamo quindi alcuni aspetti relativamente all’efficacia:
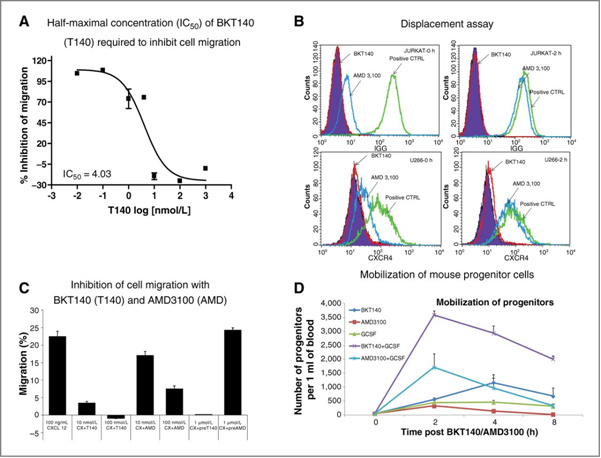
Modello murino pre-clinico:
Il grafico sopra mostra, nei modelli murini, i risultati ottenuti nella mobilizzazione cellulare dei progenitori da parte di BKT140 vs Mobozil (D), in combinazione con il G-CSF. Come si può vedere dal grafico la combinazione BKT140-G-CSF riesce a indurre la mobilizzazione di un numero 2 volte maggiore di progenitori rispetto al G-CSF + Mobozil.
Trial clinico:
Come si può vedere dalla figura, anche nello studio clinico il BL-8040 è capace di indurre la mobilizzazione di un alto numero di cellule progenitrici.
Non mi soffermerò ulteriormente sui risultati dello studio pilota di fase 1. Chi volesse leggere tutto il paper per approfondire l’argomento trova il materiale a questo indirizzo:
http://clincancerres.aacrjournals.org/content/20/2/469.long
Alla luce dei risultati ottenuti sia negli studi pre-clinici che nello studio pilota, credo che il trial di fase 1, che partirà durante il 1H14 con risultati nel 2H14, se correttamente impostato, non dovrebbe portare grosse sorprese.
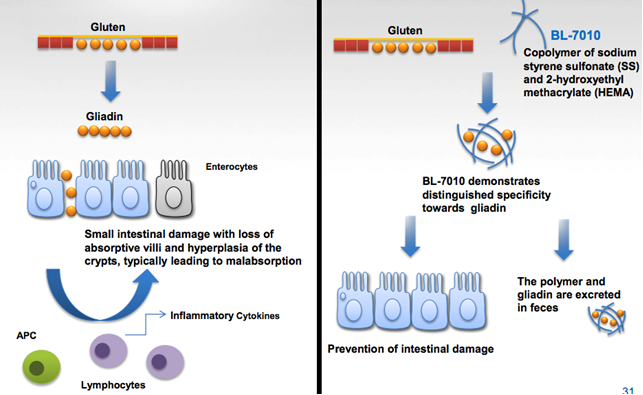
4) BL-7010 – Polimero con alta affinità per le gliadine (peptidi immunogenici contenuti nel glutine)
Trial clinico NCT01990885 di fase I/II, in due parti, randomizzato, in doppio cieco e con placebo, che testa la sicurezza e la tollerabilità di singole e molteplici somministrazioni del farmaco in pazienti sotto stretto controllo medico.
Inizialmente non sono previsti endpoint di efficacia. Nella seconda parte dello studio verrà invece testata l’efficacia del trattamento oltre la sicurezza dopo una somministrazione orale del farmaco per 6 settimane.
I risultati della prima parte dello studio clinico sono previsti per metà 2014. Il primo paziente è stato arruolato in Finlandia nel Dicembre 2013.
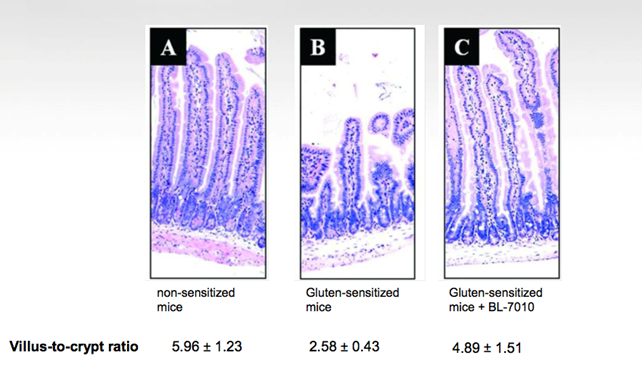
Gli studi preclinici sui topi hanno dimostrato come il trattamento con BL-7010 sia stato utile per dimuire la risposta del sistema immunitario che porta a danno intestinale e atrofia dei villi.
Bl-7010 si lega alla proteina del glutine riducendone la tossicità. Quindi il farmaco, con la molecola attacata, passa attraverso il sistema digestivo e viene escreto con le feci.
BL-7010 non è mai stato testato negli uomini prima d’ora, nonostante siano stati effettuati studi pre-clinici su biopsie di tessuto di pazienti celiaci, dove si è visto che il farmaco è effettivamente efficace nel diminuire la risposta del sistema immunitario.
Il potenziale di mercato è enorme. Poiché siamo nelle fasi preliminari di sviluppo è difficile fare qualsiasi previsione sul reale valore dell’asset. Vale la pena ricordare che BL-7010 ha già molti concorrenti in fase più avanzate di sviluppo, in particolare ALV003 di Alvine Pharmaceuticals, attualmente in fase 2b, che ha già ricevuto lo status di “fast track” dalla FDA e che è in partnership con AbbVie (dalla quale ha ricevuto $70M come milestone payment).
Gli altri concorrenti sono: AT-001 di Alba Therapeutics (in partnership con Cephalon) in fase III e anche esso designato come “fast track” dalla FDA e Nexvax2 di ImmusanT attualmente in fase 1 in Australia, Nuova Zelanda e USA.
5) BL-5010P (dispositivo applicatore monouso per la rimozione non chirurgica di lesioni benigne della pelle)
Nel Gennaio 2014 ha ricevuto il via libera dalle autorità tedesche per condurre uno studio chiave (registrativo), al fine di ottenere il marchio CE, per una nuova formulazione di componenti approvati per il trattamento di lesioni benigne della pelle (cheratosi sebboroica), utilizzando un dispositivo erogatore monouso.
Per approfondimenti circa la cheratite sebboroica e l’applicatore:
Per il funzionamento dell’applicatore:
http://www.youtube.com/watch?v=S3bBmIa7KKU
Il trial clinico partirà nel 1H14. Bioline prevede di arruolare fino a 20 pazienti. L’endpoint primario è l’efficacia di una singola applicazione di BL-5010p nella rimozione delle lesioni determinate da cheratosi sebboroica. La rimozione completa delle lesioni verrà valutata 30, 90 e 180 giorni dopo il trattamento.
L’endpoint secondario sarà la sicurezza, la tollerabilità e il risultato cosmetico della procedura valutata sia dall’investigatore dello studio che dal paziente. Si valuterà inoltre la possibilità di preservare le lesioni rimosse per eventuali analisi istopatologiche.
In uno studio pilota precedente di fase I/II conclusosi nel Dicembre 2010, Bl-5010 ha mostrato buoni risultati. Lo studio ha dimostrato che il 97% dei pazienti arruolati (n=60) ha avuto la rimozione della lesione entro un mese dal trattamento.
Bioline ha stretto un’accordo con Innovative Phamaceuticals Company nel Novembre 2007 per BL-5010 e attualmente ha i diritti per sviluppare, commercializzare e vendere BL-5010 in tutto il mondo.
6) BL-8020 (Hydroxychloroquine + Ribavirin) per l’infezione da HCV
Trial clinico NCT01833845, di fase I/II, proof-of-concept, open-label ad un solo braccio e due periodi di trattamento. Il primo periodo di trattamento prevede la somministrazione della Ribavirina come monoterapia per 8 settimane, mentre il secondo periodo di trattamento prevede la somministrazione di Ribavirina + HCQ per un periodo di 16 settimane.
Lo scopo dello studio è quello di valutare l’efficacia e la sicurezza (endpoint primari) del trattamento combinato contro l’efficacia del solo trattamento con Ribavirina. La società prevede di arruolare fino a 40 pazienti. I risultati sono attesi nel 2H14.
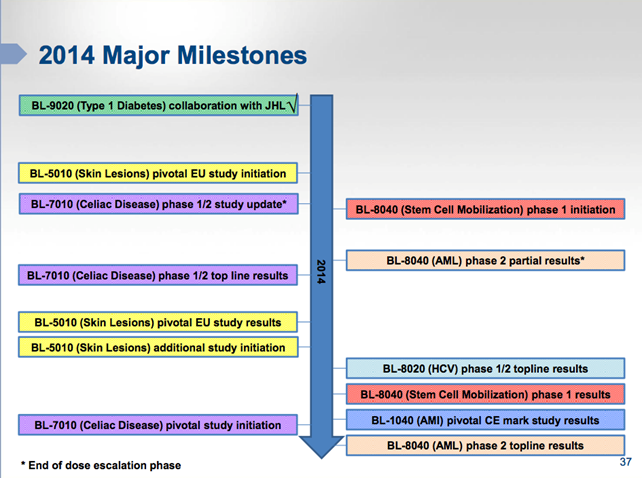
Ecco infine riassunti in un’unica immagine tutti gli eventi del 2014 per Bioline:
SITUAZIONE FINANZIARIA
Prima di dare un’ occhiata ai conti dell’azienda è importante verificare come si stanno muovendo gli istituzionali. Sarà un caso ma con l’avvicinarsi di alcune importanti scadenze per l’azienda qualcosa si è mosso. Poco tempo fa l’azienda aveva una quota di istituzionali intorno al 12%, ma proprio il 13 Febbraio, attraverso una 13G/A, Orbimed Israel Biofund Gp Limited Partnership, già presente tra gli istituzionali, ha aggiunto 25 milioni di azioni e quindi ha in mano il 9,9% del capitale.
Anche a fine 2013 ci sono stati tre ingressi nuovi sul titolo da parte degli istituzionali, l’unico da segnalare è questo con ben 713mila azioni:
| OPALEYE MANAGEMENT INC. |
12/31/2013 |
713,000 |
713,000 |
Per quanto riguarda la situazione finanziaria, l’azienda ha riportato di avere $20,3M in cassa al 30/9/13, sufficienti per finanziare le operazione fino alla prima metà del 2015 (in base alla guidance fornita durante la presentazione di Febbraio).
Il consumo di cassa è basso, circa $12M/anno, non sono presenti debiti e il numero di azioni in circolazione è di 24M (29,6M su base diluita).
L’azienda a Maggio 2013 ha ufficializzato un programma di vendita di azioni a mercato ATM
(con Stifel) per raccogliere circa 20M di $.
A febbraio 2013 ha chiuso un offerta di $8M per la vendita di 2,7M di azioni a $3, insieme all’emmissione di 1,6M di warrant esercitabili al prezzo di $3,94.
Sulla base degli acquisti degli istituzionali e della situazione di cassa che avete letto sopra, la situazione finanziaria non sembra al momento preoccupante.
Tuttavia bisogna tenere conto che il 2014 sarà un anno ricco di eventi significativi per Bioline e con l’inizio previsto di numerosi trial clinici il consumo di cassa potrebbe aumentare.
Pertanto non è da escludere che, una volta finito l’ATM (o con l’ATM prossimo alla fine), l’azienda possa decidere di diluire, magari proprio in seguito al risultato positivo di un trial clinico chiave (come quelli previsti nella seconda parte del 2014).
STRATEGIA DI TRADING
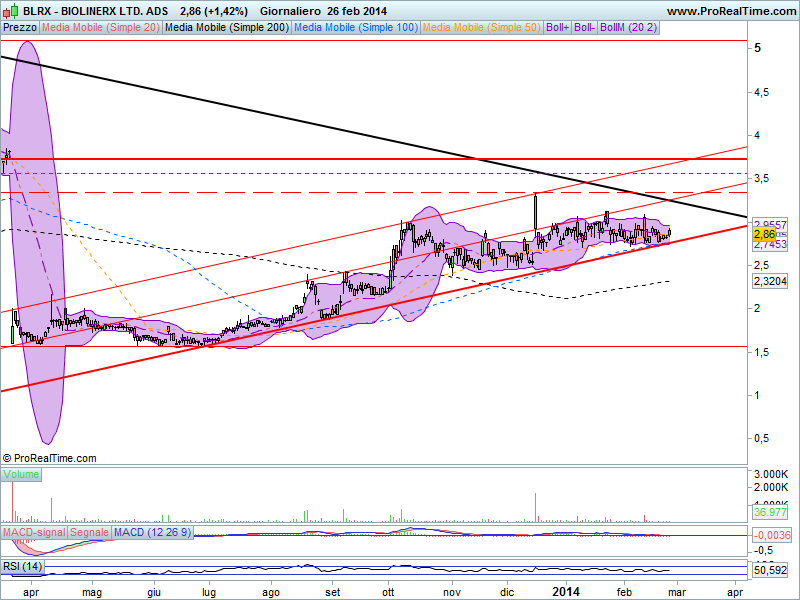
Situazione tecnica piuttosto interessante per il titolo, che dal marzo 2013 viaggia in un canale ascendente che ha consentito a BLRX di recuperare circa un 80% dal minimo di 1,57 dollari ai valori attuali, poco sotto i 3 dollari.
Nel grafico ho evidenziato con tratto marcato in nero la discendente di medio periodo, determinata dai due massimi successivi registrati il 24 gennaio 2012 ed il 1 febbraio 2013, e con tratto rosso più spesso la rialzista, supporto del canale ascendente,
che insieme vanno a formare un triangolo che sta andando sempre di più a comprimere le quotazioni. La prossima rottura ribassista o rialzista ci consentirà di avere nel breve un’indicazione del movimento che seguirà, movimento che potrebbe anche essere piuttosto consistente dopo l’attuale fase laterale . Una rottura a ribasso proietterebbe le quotazioni sulla media mobile a 200 giorni, attualmente poco sopra i 2,30 dollari. Viceversa, se il titolo andrà in rottura sullla dinamica discendente, si andrà configurando
un prossimo trend rialzista, con primo target up il massimo dell’ultimo periodo a 3,34 e, a seguire, la chiusura del gap lasciato aperto a 3,72 dollari.
In questa fase laterale gli oscillatori non ci danno molte indicazioni, trovandosi in zona neutra.
CONCLUSIONI
Bioline ha una pipeline ricca e variegata e l’anno che si appresta ad affrontare è ricco di eventi importanti, alcuni dei quali potrebbero cambiare le sorti dell’azienda.
In particolare, l’evento più importante è l’esito del trial registrativo in Europa per il BL-1040, che se avrà successo consentirà all’azienda di ricevere gli oltre $200M frutto dell’accordo con Ikaria. Il che, per un’azienda che capitalizza soli $69M, è un grosso colpo.
Inoltre, un successo in questo trial permetterebbe di iniziare immediatamente un’ altro studio di fase 3 negli USA (con conseguente ampliamento del potenziale mercato di vendita del farmaco).
Fondamentali saranno poi i risultati del trial di fase II per il BL-8040 nell’AML, per capire il reale potenziale di questo farmaco e conseguentemente anche i risultati dello stesso nel trial di fase 1 nella mobilizzazione cellulare.
Tutti questi eventi, in grado di muovere pesantemente la quotazione, sono tuttavia concentrati nell’ultima parte dell’anno, che sarà quindi un periodo “caldo” per il titolo.
L’unica eccezione è rappresentata dai risultati parziali del BL-8040 nell’AML previsti a metà anno.
Gli altri eventi a nostro parere sono “di contorno”, vuoi perché i farmaci sono nei primi stadi di sviluppo e magari dovranno competere in un mercato già saturo, vuoi perché è difficile capirne il loro reale valore e potenziale.. Inoltre la stessa società, durante la presentazione a Febbraio, ha fatto capire chiaramente come gli asset su cui punta veramente siano il BL-8040 e il BL-1040. L’outsider potrebbe essere l’asset della celiachia se dovesse rivelarsi in qualche modo efficace e superiore ai potenziali concorrenti.
Restano fuori, ovviamente, tutti i possibili nuovi accordi che l’azienda potrebbe stringere prima della fine dell’anno per valorizzare i propri asset pre-clinici e che di conseguenza potrebbero aggiungere valore al titolo.
Una strategia di investimento sul titolo potrebbe essere quella di una piccola posizione iniziale da tenere durante la prima parte dell’anno per sfruttare l’eventuale rialzo dovuto magari a nuovi accordi e con questa andare a vedere le carte dei risultati parziali per il BL-8040. A quel punto, e solo allora, si potrà decidere se vale la pena una posizione “full”.
La nostra opinione è che il potenziale risk/reward di questo investimento sia certamente attrattivo. La ricca varietà di candidati e la situazione finanziaria dell’azienda (senza debiti) possono certamente limitare la caduta delle quotazioni in caso di fallimento di un trial clinico chiave, mentre un successo in uno dei 2 asset può spalancare le porte a grossi movimenti rialzisti.
Report a cura di: Gooser, Matteo, Giorgio e Davide
papi67@finanza:
ammazza che articolo, colossale Grazie
Ragazzi ma chi siete? Uno spettacolo!!! Complimenti
Ragazzi vi chiedo un favore per non appesantire la pagina limitiamoci solo a commentare l’articolo. Per l’operatività e il resto usiamo l’ultimo articolo come stiamo già facendo.
Grazie
Approfitto per ringraziare Davide, Matteo e Giorgio. Senza di loro non avremmo potuto realizzare il nostro primo report !! GRAZIE RAGAZZI !!! 


CLAP CLAP CLAP….CHAPEAU SIGNORI, stavolta vi siete davvero superati. La mia personale standing ovation a tutti gli autori.
nota personale, io ho una figlia celiaca e leggere che qualcosa può migliorare la situazione attuale mi conforta. Tenere presente che la celiachia non è ancora diagnosticata quanto servirebbe perchè spesso viene scambiata per altri disturbi (digestivi, psicosomatici) e mi hanno detto che può insorgere a qualsiasi età, una volta che si è predisposti.
Dopo le minaccie di GOOSER di la 
 ..e vista la mia ignoranza sui farmaci e l azienda(per ora) posso solo dire grazie ragazzi lavoro immenso!!siete i nostri eroi!!
..e vista la mia ignoranza sui farmaci e l azienda(per ora) posso solo dire grazie ragazzi lavoro immenso!!siete i nostri eroi!! 

complimenti a tutta la squadra.
Qualcuno a notizie di NEVRON. Grazie
Devi essere connesso per inviare un commento.






ammazza che articolo, colossale Grazie